KBIOHealth 비임상지원센터, 유효성평가 기술서비스 지원
오송첨단의료산업진흥재단(이사장 차상훈, 이하 ‘KBIOHealth’) 비임상지원센터의 유효성평가 기술서비스를 통해 국내 기업이 위암 환자 대상 치료용 암 백신 후보물질(AST-301)의 글로벌 임상2상 IND 승인이 완료됐다고 지난 21일 밝혔다.
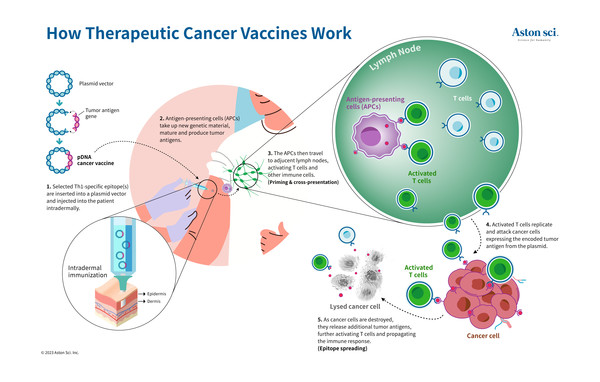
AST-301은 HER2 항원을 코딩한 DNA 기반 암 치료 백신으로, 적응증을 유방암과 위암으로 나눠각각 임상을 진행 중이다. 현재 미국, 호주 그리고 대만에서 유방암을 대상으로 하는 연구가 진행 중이다.
위암은 아시아에서 발생률이 높은 암 종이지만 HER2 발현 위암 환자 대상으로 진행한 연구가 많지 않은 상황이다. 고위험군 환자에서 수술 후 재발을 예방할 수 있는 효과적인 보조 치료가 필요하지만 선택지가 적어, 새로운 치료의 도입이 시급한 분야다.
KBIOHealth로부터 기술서비스를 지원받은 애스톤사이언스(대표이사 정헌, 신헌우)는 자체적으로 구축한 위암세포 이종이식 종양 마우스 모델에서 AST-301의 단독 투약으로도 우수한 종양 억제 효과를 확인했다. 이를 바탕으로 대만 FDA로부터 임상2상 시험 승인을 획득했다.
차상훈 이사장은 “KBIOHealth는 바이오헬스산업 생태계 발전을 위해 글로벌 수준의 서비스를 제공하는 공공 CRDMO로서, 애스톤사이언스와 같은 기업들의 아이디어를 신속히 제품화·상용화할 수 있도록 지원하고 있다”며 “앞으로도 지속적인 첨단바이오의약품 개발지원을 통해, 바이오헬스 관련 국내 기업의 글로벌 진출을 위한 디딤돌이 되도록 노력하겠다”고 말했다.
애스톤사이언스 정은교 최고의학책임자는 “일부 위암이 면역관문억제제에 반응하는 것으로 미뤄보아 항암백신처럼 새로운 기전의 면역치료가 환자의 생존율 개선에 도움을 줄 수 있을 것”이라며 “이번 임상시험을 통해 AST-301이 HER2 발현 위암 치료에 대한 새로운 치료 선택지로서의 가능성을 알리고 위암에 대한 면역치료의 범위를 넓히는 데 중요한 역할을 할 것으로 기대한다”고 전했다.
도복희 기자 phusys2008@dynews.co.kr